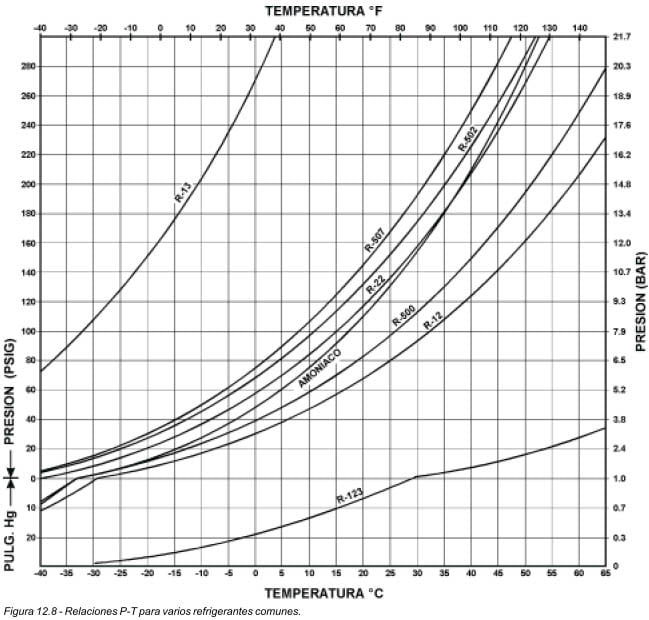
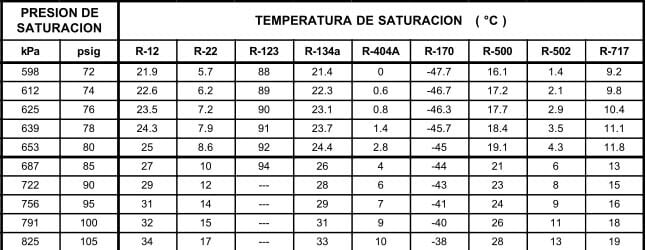
En la escala vertical se tiene la presión en kilo pascales (o en psig), y en la escala horizontal se tiene la temperatura en grados centígrados (o en grados Fahrenheit). Cualquier punto sobre la curva, representa el punto de ebullición del refrigerante. Cada punto también se puede llamar "punto de condensación". La razón es que, cualquier mezcla de líquido y vapor a la temperatura y presión de saturación, puede estar en cualquiera de las tres etapas: ebullición, condensación o equilibrio. Depende de la transferencia de calor que se esté llevando a cabo. Si se agrega calor, el líquido hierve; si se quita calor, el vapor se condensa y si no se agrega ni se quita calor, la mezcla permanece en equilibrio. Para encontrar la presión del refrigerante a una temperatura determinada, se lee verticalmente desde el valor de dicha temperatura, hasta tocar la curva; y luego, se mueve horizontalmente, hasta la escala de presión, donde se leerá la presión de saturación a esa temperatura.
Por ejemplo, la presión de vapor del R-507 a una temperatura de 10°C (50°F), es de 8.4 bar (107 psig). La temperatura es siempre la temperatura del refrigerante. La misma curva puede utilizarse para determinar presiones y temperaturas, tanto de evaporación como de condensación. Al utilizar estas gráficas, es necesario tener presente varias cosas:
1. La temperatura del refrigerante en el evaporador, es aproximadamente de 4 a 7°C más fría, que la del evaporador cuando está trabajando el compresor.
2. Cuando el compresor no está trabajando, la temperatura del refrigerante en el evaporador, es la misma que la del evaporador.
3. La temperatura del refrigerante en un condensador enfriado por aire, está entre 17 y 19°C más caliente que la temperatura ambiente.
4. La temperatura del refrigerante en un condensador enfriado por agua, es aproximadamente 10°C más caliente que el agua de la salida.
5. La temperatura del refrigerante en el condensador, será aproximadamente la misma que el medio de enfriamiento, después que la unidad haya sido apagada por 15 a 30 minutos.
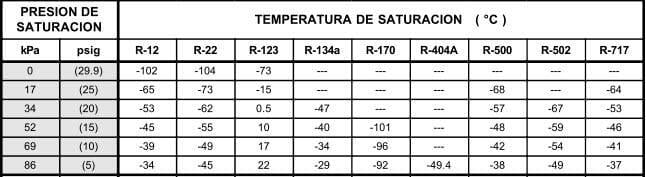
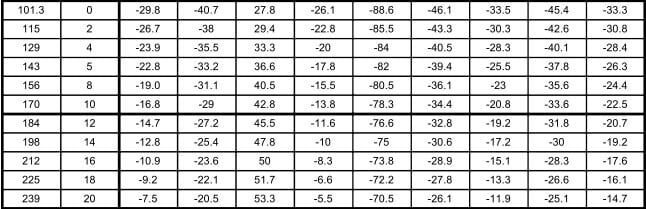
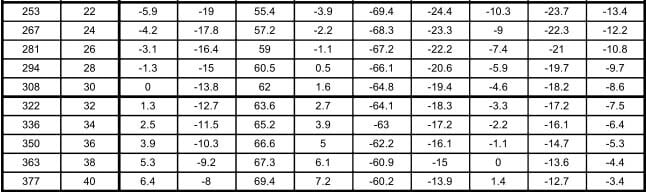
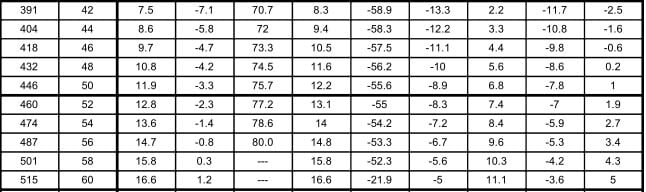
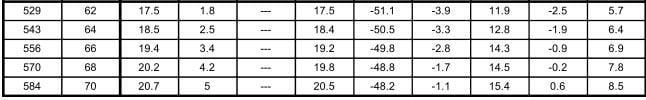
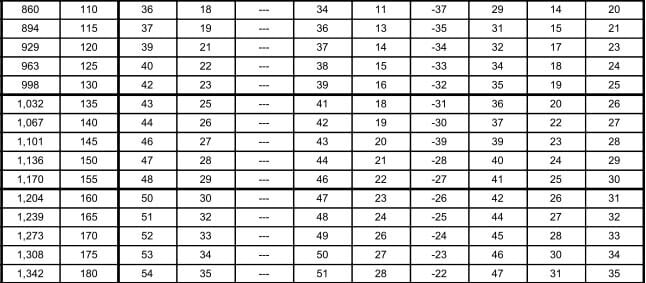
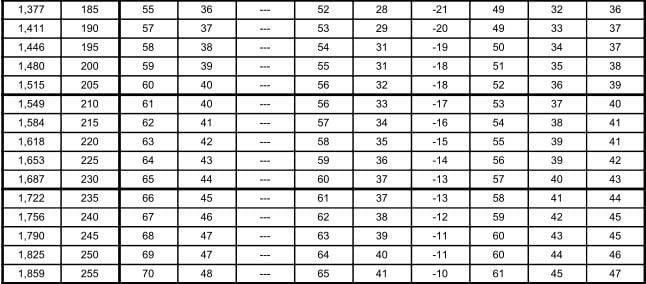
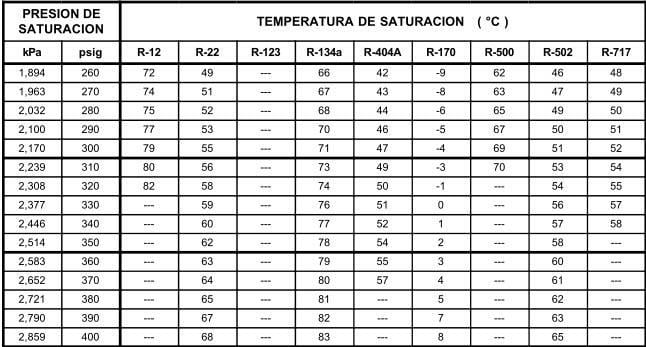
En la tabla 12.9, se muestran las relaciones entre las presiones en kilo pascales (kPa) y libras por pulgada cuadrada manométrica (psig), y las temperaturas en °C para los diferentes refrigerantes seleccionados para comparación. Los valores de la presión en el área sombreada, indican pulgadas de mercurio abajo de la presión atmosférica normal.
Las tablas de presión temperatura como la 12.9, son muy valiosas en lo que se refiere a los puntos de saturación, pero tienen sus limitaciones. Un líquido apartado de su vapor puede enfriarse abajo de su temperatura de saturación; tal líquido se denomina "sub-enfriado". Un vapor apartado de su líquido puede calentarse arriba de su temperatura de saturación; tal vapor denomina "sobrecalentado". Así, el agua a la presión atmosférica está subenfriada, si se encuentra a menos de 100°C, y está saturada, si está a 100°C. El vapor estaría saturado si se encuentra a 100°C, pero si se separa del agua y se calienta, se elevará su temperatura para formar vapor sobrecalentado.
Un líquido no puede sobrecalentarse, pues herviría; y un vapor no puede sub-enfriarse, ya que se condensaría.
Estas correspondencias de presión-temperatura de saturación, sólo son válidas cuando el líquido y el vapor están en contacto uno con otro. Esta condición existe en el evaporador y en el condensador. También existe en tanques de refrigerante que no están totalmente llenos de líquido. El vapor está, entonces, sobre el líquido.
El refrigerante líquido en el tanque recibidor o en la línea de líquido, puede o no estar sub-enfriado. El vapor de succión que entra al compresor debe estar sobrecalentado; esto es, más caliente que en el evaporador. La temperatura del gas en la descarga del compresor, está sobrecalentada, es decir, más caliente que la temperatura de condensación.
3. Volumen
Cuando se comparan densidades de gases, es común expresarlas en volumen específico. El volumen específico de un refrigerante en fase vapor, no es otra cosa, que el volumen en metros cúbicos (m³) o en litros (l) que ocupará un kilogramo de refrigerante a condiciones normales; esto es, a una temperatura de 20°C y a la presión atmosférica de 101.3 kPa. (14.7 psia).
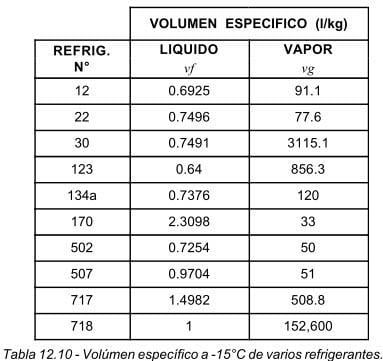
En la figura 12.10, se muestran los volúmenes específicos en las fases líquida y vapor, para los diferentes refrigerantes seleccionados, a una temperatura de -15°C (5°F). El R-718 (agua) está considerada a una temperatura de 4°C, ya que a la temperatura de -15°C estaría congelado.
En un sistema de refrigeración, al agregar calor al refrigerante, aumenta su temperatura y su volumen específico, pero su presión permanece constante; ya que, en el evaporador, en la línea de succión y en el condensador, la temperatura de saturación es lo que controla la presión del vapor sobrecalentado. Inversamente, si disminuye la temperatura del refrigerante, disminuye su volumen específico.
Como puede observarse en la figura 12.10, el volumen específico en fase líquida del R-718 (agua) es 1.0 l/kg, esto significa que un kilogramo de agua líquida ocupa un volumen de un litro. Por esta razón, el agua es el líquido que se usa como referencia para comparación con otros líquidos.
A excepción del R-170 y del R-717, los demás refrigerantes tienen un volumen específico en fase líquida menor a 1.0 l/kg; aunque este valor no tiene gran importancia. El valor que es de más utilidad en trabajos de refrigeración, es el volumen específico en fase vapor. Este valor, no es otra cosa, que el volumen en litros ( o en metros cúbicos ) que ocupa un kilogramo de refrigerante al pasar de líquido a vapor. Obviamente como es de esperarse, este valor debe ser lo más bajo posible, ya que de este valor dependerá el desplazamiento volumétrico del compresor.
Observando los valores de volumen específico en fase vapor de la figura 12.10, vemos que el R-30 y el R-123 tienen valores muy altos, por lo que estos refrigerantes no se recomienda usarlos con compresores reciprocantes, ya que se requerirá un compresor con gran desplazamiento volumétrico, debido a la gran cantidad de vapor que producen al evaporarse. Un kilogramo de R-30, cuando pasa de líquido a vapor a -15°C, de ocupar un volumen de aproximadamente 3/4 de litro, en fase líquida, su vapor tendría un volumen de 3,115 litros (3.115 m³). Por esta razón generalmente los refrigerantes con alto valor de volumen específico en fase vapor, se utilizan con compresores centrífugos, los cuales manejan grandes cantidades de vapor de refrigerante.