Relaciones entre Temperatura y Presión
Relaciones entre Temperatura y Presión
Para entender mejor el funcionamiento de una válvula de termo expansión, es fundamental entender lo que es el sobrecalentamiento, y para entender este último, se deben conocer las relaciones entre la presión y la temperatura para cualquier fluido.
Cuando aplicamos calor a una sustancia y la presión permanece constante, la sustancia sufrirá algunos cambios, tales como variaciones en su temperatura o cambios de estado. En la figura 6.3, se muestran los cambios que ocurren cuando se le aplica calor a un kilogramo de agua que se encuentra originalmente a 0 °C y a la presión atmosférica:
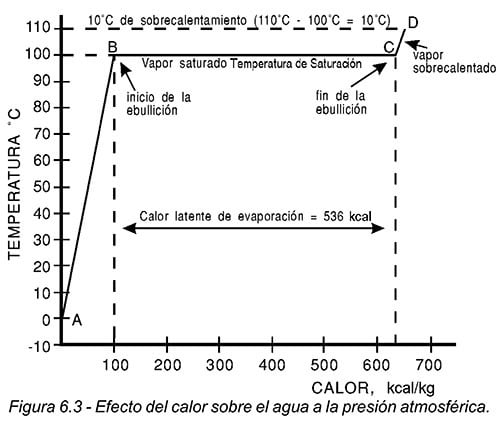
1.La línea A-B representa el calor sensible, necesario para elevar la temperatura del líquido desde 0 °C (punto de congelación), hasta 100°C (punto de ebullición). Se requiere un total de 100 kilocalorías.
2. A partir de este punto ("B"), si se sigue agregando continuamente calor, la temperatura del agua no cambia, permanece en 100°C, lo que cambia es su estado pasando de líquido a vapor. Esta condición continúa hasta que se evapora la última gota de agua (punto "C"). El vapor producido durante la ebullición, tiene la misma temperatura que el líquido y se le conoce como vapor saturado. El calor total requerido para evaporar un kilogramo de agua es de 536 kilocalorías, y se conoce como calor latente de evaporación.
3.Si todo el vapor producido por el kilogramo de agua se sigue calentando, se elevará su temperatura arriba de 100°C. Este calor se llama sensible. La temperatura arriba de 100°C es el sobrecalentamiento y también se mide en grados. En el punto "D" de la figura, se muestra claramente que el vapor a 110°C y presión atmosférica es vapor que ha sido sobrecalentado 10°C.
