Los CFC's y la Capa de Ozono
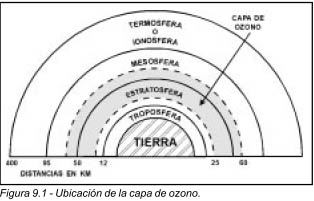
La capa de ozono es una delgada capa dentro de la atmósfera de la tierra, comienza aproximadamente a unos 25 km arriba del suelo, y se extiende hasta más de 35 km de ancho (figura 9.1). Se sabe que esta capa cambia su espesor dependiendo la estación del año, hora del día y temperatura. Con frecuencia se le llama pantalla o escudo. A la capa de ozono se le acredita como protectora contra los dañinos rayos ultravioleta (UV) del sol. La capa de ozono funciona como un filtro para estos rayos y protege la vida humana, vegetal y marina de sus efectos dañinos. Existen teorías actualmente aceptadas, de que los rayos UV son los principales causantes de cáncer en la piel, y de provocar cambios en los ciclos biológicos de algunas plantas y organismos submarinos.
Desde hace muchos años, se había sostenido la teoría de que algunos gases emitidos desde la tierra, principalmente cloro y bromo, deterioran la capa de ozono. Esta hipótesis, presentada desde 1974 por los científicos Molina y Rawland (Premio Nobel de Química 1995), fue posteriormente confirmada por estudios de la NASA, mediante el uso de satélites y detectores de ozono, principalmente en la Antártida, donde el problema parece ser más serio. Las últimas investigaciones realizadas en la atmósfera, indican que puede haber un "agujero" en la capa de ozono sobre la Antártida, cada primavera, hasta mediados del próximo siglo (2,050), a causa de las emisiones de cloro y bromo.
Así mismo, se ha observado que en algunas áreas densamente pobladas de ambos hemisferios, se está presentando un agotamiento de la capa de ozono de aproximadamente 3% en verano y 5% en invierno. En los trópicos no se ha encontrado disminución de esta capa.
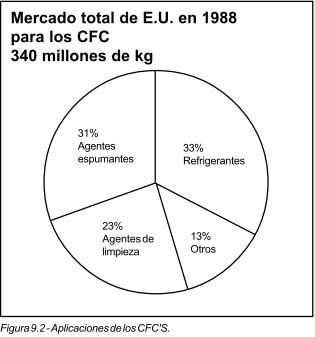
Los clorofluorocarbonos (CFC's) son una familia de compuestos químicos que contienen cloro, flúor y carbono. Fueron desarrollados hace más de 60 años y tienen propiedades únicas. Son de baja toxicidad, no son inflamables, no son corrosivos y son compatibles con otros materiales. Además, ofrecen propiedades físicas y termodinámicas que los hacen ideales para una variedad de usos. Los CFC's se utilizan como refrigerantes; agentes espumantes en la manufactura de aislamientos, empa-
ques y espumas acojinantes, propelentes en aerosoles; como agentes de limpieza para componentes metálicos yelectrónicos, y en muchas otras aplicaciones (figura 9.2).
Sin embargo, los CFC's son compuestos muy estables, por lo que al ser liberados, alcanzan grandes alturas sin descomponerse, y pueden pasar muchos años antes de descomponerse químicamente.
El cloro, importante componente de los CFC's, es el principal causante del deterioro de la capa de ozono.
Mediante una acción acelerada por la luz del sol, el cloro
se desprende de la molécula, reaccionando con una
molécula de ozono y formando una molécula de monóxido
de cloro y otra de oxígeno:
CFC + O 3 ---------> ClO + O 2
El monóxido de cloro, por ser una molécula muy inestable,
se separa fácilmente y deja el cloro libre de nuevo:
ClO ---------> Cl + O
Este radical de cloro libre comienza el proceso otra vez:
Cl + O 3 ---------> ClO + O 2
Por lo que una molécula de CFC puede destruir una
cantidad grande de moléculas de ozono, dependiendo del
número de átomos de cloro y de su estabilidad. Los CFC'S
con mayor número de átomos de cloro son el R-11 (3
átomos) y el R-12 (2 átomos), y también son los más
estables. Se estima que una molécula de R-11 puede
destruir hasta 100,000 moléculas de ozono.
Climasmonterrey.com © 2024




.jpg)

-200x200.jpg)











-200x200.jpg)



-200x200.png)